维持疗法在胃癌或胃食管交界癌中的作用尚不清楚。我们研究了avelumab (anti -程序性死亡配体-1 [PD-L1])在一线诱导化疗后对GC/GEJC的维持。 JAVELIN Gastric 100是一项全球性的开放标签III期试验。符合条件的患者为未经治疗、不能切除、人表皮生长因子受体2阴性、局部晚期或转移性GC或GEJC。采用奥沙利铂加氟嘧啶一线化疗12周后无进展的患者随机1:1分予avelumab 10 mg/kg / 2周或继续化疗,按区域分层(亚洲与非亚洲)。在所有随机分配的患者或pd - l1阳性随机分配的人群中,主要终点是诱导化疗后的总生存率(OS) (≥1% of tumor cells; 73-10 assay)。 共有805例患者接受诱导;499人随机分配到avelumab (n5249)或继续化疗(n5250)。阿夫鲁单抗与化疗的中位OS分别为10.4个月(95%可信区间为9.1 ~ 12.0个月)和10.9个月(95%可信区间为9.6 ~ 12.4个月),24个月OS分别为22.1%和15.5%(风险比[HR], 0.91;95% CI, 0.74 ~ 1.11;P=.1799)。在pdl1阳性人群(n= 54)中,OS的HR为1.13 (95% CI, 0.57~2.23;P=.6352)。在对pd - l1阳性人群的探索性分析中,定义为综合阳性评分≥ 1 (22C3试验;n =137), avelumab的中位OS为14.9个月(95%可信区间8.7到17.3个月),而化疗的中位OS为11.6个月(95%可信区间8.4到12.6个月)(无分层HR, 0.72;95% CI, 0.49至1.05)。在使用avelumab和化疗的情况下,治疗相关不良事件(TRAEs)发生149例(61.3%)和184例(77.3%),其中≥ 3级不良事件(31例(12.8%)和78例(32.8%)。 在晚期胃癌或GEJC患者中或在预先确定的pd - l1阳性人群中,JAVELIN Gastric 100并没有显示avelumab维持与持续化疗优于OS。 进展期胃癌(GC)患者预后较差。国际指南建议,对于不能切除的晚期或转移性人表皮生长因子受体2 (HER2)阴性胃癌或胃食管结合部癌(GEJC)的一线治疗,采用铂+氟嘧啶双联或三联化疗方案。然而,无进展生存时间(PFS;中位,约6个月)和总生存率(OS;中位数,9-18个月)很短。虽然维持治疗改善了一些肿瘤的PFS和OS,但其在GC/GEJC中的作用尚未确定。最近,抗编程死亡-1 (PD-1)免疫检查点抑制剂nivolumab和pembrolizumab被批准用于不同地区的晚期胃癌或GEJC患者。Avelumab是一种抗程序性死亡配体-1 (PD-L1)抗体,在各种实体肿瘤患者中显示出抗肿瘤活性和可耐受的安全性。在Ib期队列中,avelumab开关维持疗法在一线化疗后无疾病进展的晚期GC或GEJC患者中表现出令人鼓舞的活性,支持进一步的研究。我们对晚期HER2阴性GC/ GEJC患者在一线诱导化疗后进行avelumab转换维持治疗的III期JAVELIN Gastric 100 trial进行了初步分析,并与继续一线化疗进行比较。 患者:符合诱导化疗条件的患者有组织学上确诊的、不能切除的、局部晚期或转移性胃腺癌或GEJ,未接受局部晚期或转移性疾病的化疗,且每RECIST有可测量的疾病(1.1版)。其他关键入选标准为年龄≥18岁,东部合作肿瘤组表现状态为0或1,最近获得肿瘤标本(≤6个月)。主要排除标准包括her2阳性肿瘤、先前免疫检查点抑制剂治疗和未治疗或有症状的脑转移。协议中提供了完整的资格标准(数据补充,仅在线提供)。 该试验是根据涉及人体受试者的生物医学研究的国际伦理准则、良好临床实践协调准则国际会议和赫尔辛基宣言进行的。所有患者在登记前均提供书面知情同意书。试验方案和所有修订均由各参与中心的机构审查委员会或伦理委员会批准。 JAVELIN Gastric 100 (ClinicalTrials.gov标识:NCT02625610)是一项开放、多中心、随机的III期临床试验。所有患者接受一线诱导治疗长达12周,采用三种方案中的一种:根据标签说明和本地指南,奥沙利铂85 mg/m2静脉注射,亚叶酸钙200 mg/m2(或等效左乙酰叶酸钙剂量),其次为氟尿嘧啶(FU) 2,600 mg/m2,在第1天连续输注24小时,每2周一次;奥沙利铂85 mg/m2 IV和亚叶酸钙400 mg/m2(或同等剂量的左乙酰叶酸钙),第1天给予FU 400mg /m2IV,第1天至第2天给予FU 2400mg /m2by连续滴注超过46 ~ 48小时,每2周一次,或奥沙利铂130 mg/m2IV在第1天,卡培他滨1000 mg/m2IV口服每日两次,持续2周,然后每3周休息1周。 经独立放射科医师证实,诱导化疗后无进展(PD) / RECIST (version 1.1)的患者,随机按1:1分配,每2周使用avelumab 10mg /kg IV切换维持治疗或继续相同的化疗。随机分配按区域分层(亚洲与非亚洲)。所有患者都接受了最佳支持性护理(BSC)。在化疗组,不能耐受进一步联合化疗的患者可单独使用卡培他滨、FU +亚叶酸钙或奥沙利铂。被认为不适合进一步化疗的患者只接受BSC。患者在前四次avelumab输液前接受抗组胺/对乙酰氨基酚预处理。Avelumab不允许减少剂量;允许改变输注速度和剂量延迟。 根据标签说明和局部指南,允许化疗剂量的修改。所有随机分配的患者继续分配治疗,直到出现PD、不可接受的毒性、退出同意或任何其他退出标准。 主要终点是OS(从随机分配到因任何原因死亡的时间)。在所有随机分配的患者和随机分配的pd - l1阳性肿瘤患者中评估OS。对于初步分析,如统计分析计划中预先规定的,在基线时使用PD-L1免疫组化(IHC) 73-10性能评估-仅分析(Agilent Technologies/Dako, Carpinteria, CA)集中评估PD-L1状态。PD-L1阳性定义为肿瘤细胞中PD-L1蛋白表达量≥1%。次要终点包括PFS(根据研究者评估或任何原因导致的死亡,无论首先发生的是哪个,从随机分配到第一次记录PD per RECIST[版本1.1]的时间),最佳总体反应(自基线[诱导化疗后随机分配]的所有肿瘤评估中最佳反应[版本1.1])、反应持续时间(从维持阶段第一次记录客观反应到每次复发PD[版本1.1]或死亡的时间)和安全性。肿瘤在基线时进行放射学评估,前12个月每6周进行一次,之后每12周进行一次。在一项探索性亚组分析中,根据制造商的说明,使用PD-L1 IHC 22C3 pharmDx试验(Agilent Technologies/Dako)评估肿瘤和免疫细胞(淋巴细胞和巨噬细胞)中PD-L1的表达情况,将PD-L1阳性定义为联合阳性评分(CPS) ≥1。采用Idylla MSI试验(Biocartis, Mechelen,比利时)评估微卫星不稳定性(MSI)状态(探索性分析)。不良事件(AEs)采用国家癌症研究所不良事件通用术语标准(4.03版)分级。免疫相关的AEs使用预先指定的首选术语列表,然后进行全面的医学审查。 最初的主要目的是在所有随机分配的患者中显示avelumab维持比继续一线化疗更好的OS或PFS。2018年6月(在中期分析和获得患者数据之前),基于avelumab在GC和GEJC中的Ib期研究结果,显示pd - l1阳性人群中OS更长,修正了主要目标,以证明在所有随机分配的患者或随机分配的pd - l1阳性人群中,维持avelumab比继续一线化疗在延长OS方面的优势,从而使这两个人群中OS的正式统计分析成为可能。PFS成为了次要的目标。 诱导期登记的患者数量由观察到的诱导失败率决定,大约有466名患者被随机分配。对于所有随机分配的患者,假设化疗组和avelumab组的中位OS分别为10.5和15.0个月,对应于危险比(HR)为0.70,并且有5%的漏失率,在单侧a为2%的对数秩检验中,需要356件事件(死亡)才能达到90%的几率。该计算包括在75%的OS事件发生后进行的中期疗效分析。中期和主要分析使用了对每个局域网和demet的连续a-支出函数方法和一个O 'Brien和Fleming边界函数。对于pd - l1阳性人群的OS分析,假设化疗组和avelumab组的中位OS分别为10.5个月和19.3个月,对应的HR为0.54。 如果在总体或pd - l1阳性人群中拒绝OS的零假设检验,则认为主要终点为阳性。两个主要假设采用不平衡的I型错误分配,将错误率控制在2.5%(单侧),而pd - l1阳性总体错误率为2%和0.5%(单侧)。计算使用EAST(6.4版本;Cytel,剑桥,MA)和R软件(R Foundation,维也纳,奥地利)。使用加权Bonferroni检验的封闭检验程序分析OS的双重主要假设检验。如果一个种群中的OS比较比较显著,则将回收a值用于另一个种群的OS比较。使用Kaplan-Meier方法估计OS和PFS。客观有效率(ORRs;采用Cochran-Mantel-Haenszel检验比较治疗组完全缓解[CR]和部分缓解[PR]的最佳总体缓解比例,分层核算,单边a水平为0.025;采用Clopper-Pearson方法计算双侧95% ci。在维持阶段接受随机分配的一剂治疗的患者中进行了安全评估。 2015年12月31日至2017年11月29日,来自17个国家178个地点的805名患者进入了为期12周的诱导期(Appendix Table A1,,)(Fig 1)。随后,将499名疾病控制患者随机分配到阿夫鲁单抗维持组(n5 249)或持续化疗组(n5 250),其中分别为30名和24名患者,基于预先定义的pd - l1阳性肿瘤(表达在≥1%的肿瘤细胞中;73 - 10测定)。在化疗组中,有7例患者(2.8%)被认为不适合进一步化疗,仅接受BSC治疗。两组的基线特征相似(Table 1)。截止到2019年9月13日,18名患者(7.2%)和5名患者(2.0%)仍在接受avelumab和化疗组的研究治疗(Appendix Table A2, online only). avelumab组维持期的中位治疗时间为3.2个月(范围0.5-34.1个月),化疗组为2.8个月(范围0.5-28.3个月),OS的中位随访时间分别为24.1个月和24.0个月(两组最小为18个月)。在avelumab组和化疗组中,分别有2.4%和8.4%的患者接受了后续免疫治疗,51.4%和49.2%的患者接受了后续化疗。 avelumab组和化疗组的OS无显著差异(Fig 2).在所有随机分配的患者中,avelumab组的中位OS(根据随机分配[即,在诱导化疗12周后]测量)为10.4个月(95% CI, 9.1 ~ 12.0个月),化疗组的中位OS为10.9个月(95% CI, 9.6 ~ 12.4个月)(HR, 0.91;95% CI, 0.74 ~ 1.11;onesidedP=.1779); 24个月的OS发生率分别为22.1% (95% CI 16.8至28.0)和15.5% (95% CI 10.8至20.9)。 在预定pd - l1阳性人群中(≥1%的肿瘤细胞;73 - 10测定;在438例评估患者中,avelumab组的中位OS为16.2个月(95% CI, 8.2个月到NR),化疗组的中位OS为17.7个月(95% CI, 9.6个月到NR) (HR, 1.13;95% CI从0.57到2.23,one-sided P = .6352)。大多数协议指定的亚组中OS趋势相似(图3),包括亚洲患者,(n= 114; HR, 0.90; 95% CI, 0.59 to 1.36; AppendixFig A1A, online only); 然而,在两个预先指定的人群中可以看到OS的差异: 诱导化疗后无转移部位的患者(n = 114;HR,0.52;95% CI, 0.28 - 0.98)和msi高肿瘤小子集(n = 13;HR,0.27;95% CI, 0.06到1.25)。 在对pd - l1阳性肿瘤的可评估患者子集(使用22C3试验定义为CPS≥1)进行的探索性分析中(213例中的137例[64.3%]),avelumab的中位OS为14.9个月(95%可信区间8.7到17.3个月),化疗的中位OS为11.6个月(95%可信区间8.4到12.6个月)(无分层HR, 0.72;95% CI, 0.49 ~ 1.05; Fig 2C)。基于22C3分析的pd - l1高肿瘤子集(CPS ≥10;n=43),没有证据显示avelumab获益,(Appendix Fig A1B)。在所有随机分配的患者中,avelumab组的中位PFS(经过随机分配)为3.2个月(95% CI, 2.8 ~ 4.1个月),化疗组的中位PFS (95% CI, 4.0 ~ 5.5个月)为4.4个月(HR, 1.04;95%置信区间,0.85至1.28;附录A2A(只供网上使用)。在预定pd - l1阳性人群中(≥1%的肿瘤细胞;中位PFS在avelumab组为4.1个月(95% CI 1.6 ~ 16.0个月),在化疗组为9.7个月(95% CI 2.8 ~ 12.5个月)(HR, 1.04;95% CI, 0.53 ~ 2.02; 附录图A2B)。在诊断为CPS ≥1 (22C3试验)的pd - l1阳性肿瘤的探索性子集中,avelumab组的中位PFS为4.3个月(95%可信区间为2.9 ~ 6.8个月),化疗组的中位PFS为5.1个月(95%可信区间为4.2 ~ 7.0个月)(未分层HR, 0.87;95% CI,从0.60到1.27)(Appendix Fig A2C)。 ORR代表随机分配的PR或经诱导化疗后病情稳定的患者的额外或加深的肿瘤反应,avelumab组为13.3% (95% CI 9.3 ~ 18.1),化疗组为14.4% (95% CI 10.3 ~ 19.4) (只适用于网上附录表A3)。在随机分配,10例诱导化疗后出现CR,但由于这些患者不再有肿瘤可监测,因此不被纳入ORR的分子,除了化疗组1例患者被误诊为维持期CR。在这个亚组中,avelumab组的3名患者和化疗组的2名患者在数据截止时没有任何疾病迹象。阿夫鲁单抗的中位见效时间为16.1周(范围5.6-96.4周),而化疗为6.4周(范围3.3-116.0周)。在随机分配后,avelumab的中位反应持续时间未达到(95%可信区间为9.7个月至不可估计),而化疗的中位反应持续时间为5.9个月(95%可信区间为4.5到7.2个月) (Fig 4)。 在12个月时,avelumab与化疗相比持续反应的概率分别为62.3%(95%可信区间40.9 ~ 77.9)与28.4%(95%可信区间13.2 ~ 45.7),在24个月时,分别为51.0%(95%可信区间29.0 ~ 69.4)与13.5%(95%可信区间3.1 ~ 31.6)。 在维持期,任何因果关系的AEs发生在243名接受avelumab治疗的患者中的223名(91.8%)和238名接受化疗的患者中的214名(89.9%),其中≥3级AEs分别发生在132名(54.3%)和128名(53.8%)(Appendix Table A4, online only)。在avelumab和化疗组中,任何级别的治疗相关 (TRAEs)发生149例(61.3%),184例(77.3%),其中≥3级traes(31例(12.8%)和78例(32.8%)。avelumab组最常见的≥3级TRAEs为淀粉酶升高、脂肪酶升高、虚弱、结肠炎、食欲下降、高血压和肺炎(n5 2例各[0.8%]),化疗组出现中性粒细胞减少(n= 19[8.0%])、中性粒细胞减少(n= 10[4.2%])和周围感觉神经病变(n5=8 [3.4%]);Fig 5)。在avelumab组和化疗组中,19名患者(7.8%)和23名患者(9.7%)出现了严重的复发,25名患者(10.3%)和65名患者(27.3%)的复发导致永久停药。1例患者因化疗发生脑血管事件而死亡。在avelumab组,32名患者(13.2%)有免疫相关AE,包括8名患者(3.3%)发生$ 3级事件。最常见的免疫相关ae(≥ 2.0%)是甲状腺功能减退(n=7[2.9%])、肺炎(n= 6[2.5%])和皮疹(n=5[2.1%])。 在GEJC的晚期胃癌患者中,在一线诱导化疗后病情得到控制的情况下,JAVELIN Gastric 100试验并没有达到证明切换维持avelumab比持续化疗具有更好的OS的主要目的,无论是总体还是预先确定的pd - l1阳性人群(≥1%的肿瘤细胞;73 - 10测定)。与化疗相比,24个月的OS率(22.1% vs 15.5%)和反应时间(24个月持续反应的概率,51.0% vs 13.5%)出现了不显著的趋势。在探索性亚群分析的基础上,avelumab与化疗在无转移位点的亚组中出现OS差异; 尽管HR(0.06到1.25)的95% CI与1重叠;在PD-L1阳性肿瘤患者中,定义为CPS≥ 1 (22C3 assay),说明PD-L1蛋白在肿瘤细胞、淋巴细胞和巨噬细胞中的表达情况,从而代表进一步评估的可能区域。 与持续化疗相比,Avelumab显示了良好的安全性,包括较低的3级TRAEs (12.8% v 32.8%)、因TRAEs而永久停药(10.3% v 27.3%)以及治疗相关胃肠AEs、血液学AEs和神经病变的减少。avelumab的安全性与之前avelumab单药治疗研究一致。 抗pd -1抗体被批准用于胃癌和GEJC的晚期治疗,但据我们所知,在任何一线中,III期均未显示出与化疗相比的统计学优势。在所有随机分配的患者的OS分析中,avelumab与化疗组的Kaplan-Meier曲线在初始时间点较低,但在大约12个月时曲线交叉,avelumab在较晚的时间点OS曲线较高。III期KEYNOTE-062试验比较了pd - l1阳性GC或GEJC患者的一线pembrolizumab单药治疗和化疗(定义为CPS ≥ 1) (22C3试验),OS曲线与JAVELIN Gastric 100的OS曲线大致相似,尽管与化疗相比,pembrolizumab对OS的初始不利影响更为明显,这可能反映了研究设计和试验间人群富集的差异。 具体来说,在JAVELIN Gastric 100中,avelumab维持仅用于一线诱导化疗后病情得到控制的患者(即化疗敏感患者),而在KEYNOTE062中,一线pembrolizumab用于pd - l1阳性肿瘤患者(CPS ≥1)。此外,在JAVELIN Gastric 100中,OS是在诱导化疗12周后随机分配时测量的,而在KEYNOTE-062中,OS是在登记时测量的。在对pd - l1阳性肿瘤患者(定义为CPS ≥1)的探索性假设生成分析(22C3试验)中,在JAVELIN Gastric 100中,avelumab和化疗组的OS在12个月前是相似的,当曲线出现分歧时,提示这一亚组可能排除了那些在初始治疗中avelumab治疗效果较差的患者。 在key -062中,pembrolizumab与化疗对pd - l1高肿瘤患者的OS差异增加(CPS ≥10); 这在我们的研究中未见,提示高PD-L1可能不能预测化疗后疾病控制患者获益的增加。然而,在JAVELIN Gastric 100 (n=43)中很少有CPS ≥10的患者,这限制了条件。据我们所知,JAVELIN Gastric 100是GC/GEJC中免疫检查点抑制剂开关维持治疗的第一个III期试验,其结果为以后的试验提供了信息。基于预先定义的pd - l1阳性肿瘤可评估患者比例低(≥1% pd - l1阳性肿瘤细胞占12.4%;;73-10分析)意味着对该人群OS的分析能力不足。这一比例小于类似情况下avelumab Ib期研究的比例(33.3%)。在三期临床试验中,三线avelumab与化疗比较(JAVELIN Gastric 300;(26.8%),与≥1% pd - l1阳性肿瘤细胞在ATTRACTION-2((ClinicalTrials.gov identifier: NCT02267343; 13.5%; 28-8 assay)和KEYNOTE-059 studies (ClinicalTrials.gov identifier: NCT02335411; 12.5%; 22C3 assay)中的比例相当。 然而,通过CPS评估PD-L1在肿瘤细胞和免疫细胞中的表达可能更有用。大部分患者采用诱导化疗进行疾病控制,几乎所有随机分配到化疗组的患者在维持期接受持续化疗(92.4%),而不是单独使用BSC,这可能反映了实现疾病控制的患者的相对适应度。值得注意的是,化疗的中位持续时间,包括诱导治疗,约为6个月。综上所述,在晚期胃癌/GEJC诱导化疗后的疾病控制患者中,JAVELIN Gastric 100试验并没有实现维持avelumab改善OS的主要目的。然而,结果表明,在选定的患者亚群中存在潜在的活性和良好的安全性,这为今后在这一具有挑战性的疾病中的研究提供了指导。目的
患者和方法
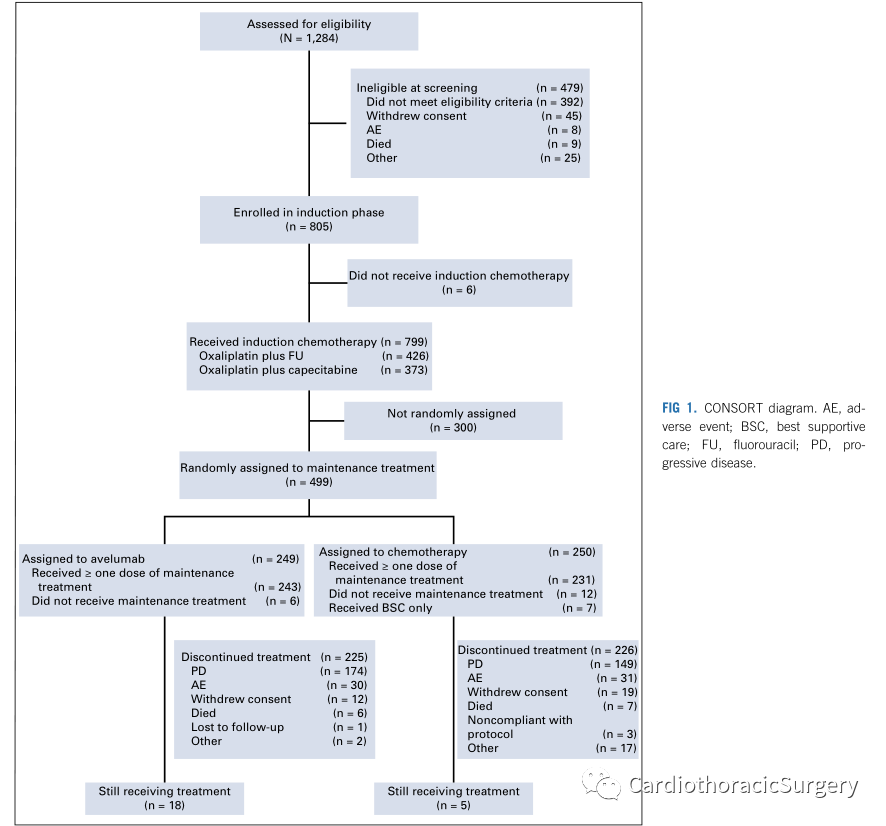
结果
结论
引言
患者与方法
研究设计和治疗
终点和评估
统计分析
结果
效果
安全性
讨论